آینده امید بخش درمان سرطان با نانوداروها
جمعه 21 آبان 1400نانوذرات با کمک به تحویل هدفمند داروها و تخریب اختصاصی سلول های توموری آینده روشنی برای درمان سرطان ایجاد می سازند.
مهم ترین مشکل داروهای سایتوتوکسیک توزیع آنها در هر دو سلول های سالم و سرطانی است که این امر سبب سمیت دارویی و اثرات جانبی زیانبار بر روی سلول های سالم می گردد. این امر کاهش دوز دارورسانی به سلول های سرطانی را به همراه دارد. برای جبران این کاهش نیاز به تجویز دارو در مقادیر بالا می باشد که از نظر اقتصادی مقرون به صرفه نیست.
نانوذرات به دلیل قابلیت های ساختاری خود می توانند بخش عمده ای از چالش های فعلی درمان سرطان را مرتفع سازند. این ساختارها به دلیل حفاظت از مولکول دارویی، کاهش سمیت و عوارض جانبی، قابلیت عبور از موانع زیستی جهت رسانش دارو به محل هدف و افزایش ماندگاری دارو در جریان خون به عنوان یک سیستم دارورسانی بسیار موثر شناخته می شوند که باعث افزایش کارایی دارو درمانی می گردد.
نانومواد می توانند طوری طراحی گردند که خواص شیمیایی و فیزیکی مطلوب و مورد نظر را کسب نموده و داروها را به طور هدفمند به محیط دینامیک توموری با اثرات درمانی بالا و سمیت کمتر هدایت گردانند. از ویژگی هایی که هنگام طراحی نانوذرات باید کنترل گردد نسبت سطح به حجم، شکل، سایز، شارژ مولکولی و رهایش دارو می باشد.
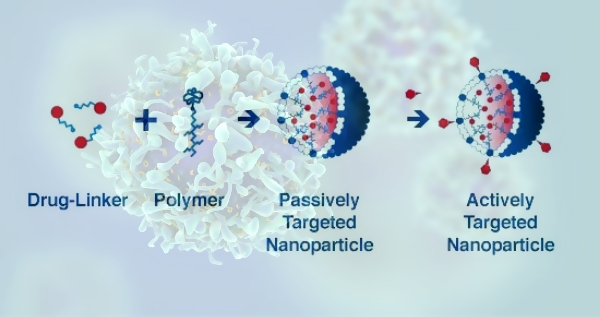
استراتژی های هدف قرار دادن سلول های سرطانی با نانو ذرات
- هدف گیری غیر فعال با استفاده از محیط بافت
روش هدف قرار دادن به صورت غیر فعال براساس اختلاف عملکردی و آناتومی بافت سرطانی نسبت به بافت سالم می باشد. در محیط توموری کاهش عملکرد لنف را داریم که سبب احتباس مواد در این ناحیه می گردد. نانوذرات را می توان طوری طراحی کرد که از سدهای بیولوژیکی که داروهای سنتی توان عبور ندارند به راحتی عبور داد. نانوذراتی که در رنج 20 تا 200 نانومتر هستند به دلیل شکننده بودن عروق خونی به داخل بافت سرطانی نفوذ می کنند و عدم تخلیه به وسیله سیستم لنفوسیتی باعث افزایش غلظت آنها در بافت سرطانی می گردد. این فرم از هدف گیری غیر فعال براساس ویژگی های محیط توموری می باشد. دارو ابتدا به مولکولی که به سلول های توموری حساس است و در عین حال به فرم غیر فعال است کونژوگه می گردد. زمانیکه این کمپلکس به تومور رسید به فرم فعال تبدیل می گردد.
اسیدیته، تغییرات دمایی و فعالیت های آنزیمی خاص در محیط توموری سبب فعال شدن دارو می گردد. بعنوان مثال اسیدیته در محیط توموری به دلیل استفاده این سلول ها از گلیکولیز نسبت به سلول های طبیعی پایین تر است. همین امر باعث توسعه دسته ای از داروها شده است. مثلا دکسوروبسین را در میکرواسفرهایی محصور می کنند که به تغییرات pH حساس است. میکرواسفرها از یک کوپلیمر و ویتامین E تشکیل شده اند که در شرایط فیزیولوژیک و 7/7= pH پایدار هستند اما در محیط اسیدی تجزیه می گردند که رهاسازی دکسوروبسین در سلول های سرطانی را به همراه دارد.
- هدف گیری فعال
در هدف گیری فعال، درمان سرطان با استفاده از لیگاندهایی مثل آنتی بادی ها، پپتیدها و آپتامرها می باشد. این لیگاندها پیش تر به نانوذرات کونژوگه می گردند. در صورت تجویز این کمپلکس به بیمار، تجمع آن در محیط توموری را خواهیم داشت. در ادامه لیگاند مد نظر به گیرنده اختصاصی در سلول های سرطانی وصل می شود و به دنبال اندوسیتوز، کمپلکس دارویی به درون سلول ها منتقل می شوند. نانوذرات وارد شده به درون سلول زمینه مرگ سلول های سرطانی را فراهم می سازند. مثلا ado-trastuzumab در سال 2014 برای درمان سرطان سینه مود تایید قرار گرفت. این دارو در ساختار خود از آنتی بادی مونوکلونال ضد HER2 و نانوذرات مهار کننده میکروتوبول ها بهره می برد.
چالش ها و آینده پیش رو
با وجود موفقیت های بدست آمده در حوزه تولید نانوداروها و ورود آنها به بازار دارویی، فعالیت در این زمینه خالی از مشکل نیست. یکی از مشکلاتی که در طراحی کونژوگاسیون نانوذرات به آنتی بادی وجود دارد تغییر در سایت اتصالی داروها به آنتی بادی و هم چنین عدم پایداری شیمیایی لینکرها بود که در نهایت سبب اثر بخشی ضعیف آنها می گردد. از مشکلات دیگر عدم پایداری ذرات نانو در جریان خون و عدم نفوذ کمپلکس دارویی به بافت سرطانی به دلیل اندازه بزرگ است. بنابراین نیاز اساسی برای طراحی سیستم های دارورسانی این است که به موانع آناتومیکی و فیزیولوژیکی بدن غلبه شود تا داروها به طور اختصاصی به سلول های سرطانی تحویل داده شوند. لذا، پیشرفت هرچه بیش تر در علم کانژوگاسیون باعث تولید نسل نانوکونژوگه ها با آنتی بادی ها، آپتامرها و ... می گردد.
انتهای پیام/

نظراتــ کاربرانــ